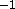 .
Beräkna kraftkonstanterna för molekylerna.
Uppskatta på basen av kraftkonstanterna vilken bindning som är den styvaste.
.
Beräkna kraftkonstanterna för molekylerna.
Uppskatta på basen av kraftkonstanterna vilken bindning som är den styvaste.
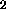 , NO, O
, NO, O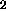 ,
C
,
C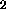 , F
, F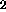 och CN kan man förvänta sig att stabliseras genom att a) addera
en elektron och bilda AB
och CN kan man förvänta sig att stabliseras genom att a) addera
en elektron och bilda AB eller b) avlägsna en elektron och bilda AB
eller b) avlägsna en elektron och bilda AB ?
?
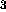 , NH
, NH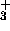 , CH
, CH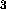 , NO
, NO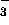 , och CO
, och CO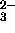 . Varför ?
. Varför ?
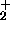 : Potentialkurvan för H
: Potentialkurvan för H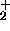 kan approximativt uttryckas
som
kan approximativt uttryckas
som
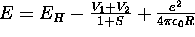 där
där  är väteatomens energi, medan
är väteatomens energi, medan 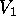 och
och 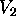 beskriver
den attraktiva växelverkan mellan kärnorna och elektronen,
och S är överlappsintegralen.
Deras värden som funktion av kärnavståndet är givet i tabellen. Rita
potentialenergikurvan och bestäm bindningsavståndet vid jämvikt samt
dissociations energin.
beskriver
den attraktiva växelverkan mellan kärnorna och elektronen,
och S är överlappsintegralen.
Deras värden som funktion av kärnavståndet är givet i tabellen. Rita
potentialenergikurvan och bestäm bindningsavståndet vid jämvikt samt
dissociations energin.
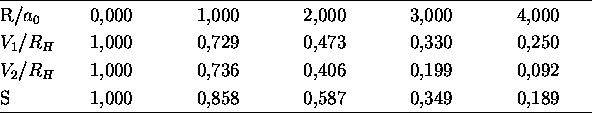
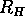 = 27,3 eV,
= 27,3 eV, 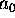 =52,9 pm, och
=52,9 pm, och 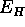 =0,5
=0,5 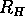 .
.
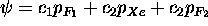 samt att
samt att 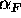 = 0,7 =
= 0,7 = 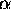 =
= 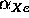 . De första
icke-diagonala termerna betecknas
. De första
icke-diagonala termerna betecknas 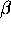 . Lös Hückelproblemet
och undersök huruvida grundtillståndet är bindande eller antibindande
när
. Lös Hückelproblemet
och undersök huruvida grundtillståndet är bindande eller antibindande
när 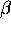 =
= 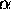 .
Notera att antalet elektroner i denna enkla modell är 4.
.
Notera att antalet elektroner i denna enkla modell är 4.
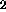 molekylen har
elektronkonfigurationen
molekylen har
elektronkonfigurationen 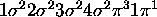 .
Eftersom molekylen är en homonukleär molekyl har den även paritets symmetri.
Bestäm den homonukleära elektronkonfigurationen för det lägsta
exciterade tillståndet
som har denna "heteronukleära elektronkonfiguration". Vilka är
tillståndets multiplicitet och paritet?
.
Eftersom molekylen är en homonukleär molekyl har den även paritets symmetri.
Bestäm den homonukleära elektronkonfigurationen för det lägsta
exciterade tillståndet
som har denna "heteronukleära elektronkonfiguration". Vilka är
tillståndets multiplicitet och paritet?